详细情况如下:通常说到淀粉样蛋白,大家通常会想到各种神经退变有关的疾病,比如阿尔茨海默病,还有帕金森病、亨廷顿病和克雅病等。所谓的“淀粉样”,指的是原本可溶的蛋白异常地形成稳定的、不可溶的沉积物,破坏神经组织。

通常说到淀粉样蛋白,大家通常会想到各种神经退变有关的疾病,比如阿尔茨海默病,还有帕金森病、亨廷顿病和克雅病等。所谓的“淀粉样”,指的是原本可溶的蛋白异常地形成稳定的、不可溶的沉积物,破坏神经组织。

“过去我们认为,淀粉样蛋白的产生通常是由于某种原因蛋白质变性或错误折叠,是一种不受控制的随机过程。”Kausik Si教授说。
然而,Kausik Si教授认为,对淀粉样蛋白的主流认识可能存在误解。Kausik Si教授师从神经生物学家、因记忆研究荣获诺贝尔生理学或医学奖的Eric Kandel教授。在2003年,他们研究加利福尼亚海兔(Aplysia californica)——记忆研究的经典模式生物时,有了惊人的发现。
在神经系统相对简单的海兔中,竟存在有生理功能的淀粉样蛋白。这种名为CPEB的蛋白与RNA结合,调控RNA翻译为蛋白质的过程,当它们聚合形成的淀粉样蛋白时,帮助海兔维持长期记忆。
后续在果蝇、小鼠等神经系统更复杂的动物中,研究人员发现,这种蛋白(在果蝇中的版本称为Orb2)也会发生自我聚合。
具体来说,CPEB/Orb2在脑中有两种结构形态,分别执行不同的功能,对于形成持久的记忆非常重要。主要形态是可溶的单体,在神经连接处(也就是突触)抑制翻译过程;而当记忆形成时,这些单体会自我组装成有生物化学活性的淀粉样蛋白,促进突触的蛋白质翻译。
 ▲研究负责人Kausik Si教授(图片来源:Stowers Institute for Medical Research)
▲研究负责人Kausik Si教授(图片来源:Stowers Institute for Medical Research)基于这些发现,Kausik Si教授认为,淀粉样蛋白并不只是病理性的“坏”蛋白,而是“可以在特定时间、特定细胞中以特定形式形成”。不过,尽管他们猜测淀粉样蛋白的状态对于Orb2来说可能很重要,但在动物的神经细胞内,“好”的淀粉样蛋白是否真正存在,需要“眼见为实”。在此次研究中,科学家们决定一看究竟。
为看清具有生化活性的蛋白结构,研究人员没有像通常那样从细菌中提取重组表达的蛋白,而是从天然的来源得到内源性蛋白。“原始环境,也就是神经系统,对于保持蛋白质的活性构象非常重要。”第一作者Ruben Hervas博士介绍。为此,他们从大约300万只果蝇的大脑中分离并纯化出足够的Orb蛋白。
![▲从大约300万只果蝇脑中分离纯化蛋白(图片来源:参考资料[1])](http://n.sinaimg.cn/tech/crawl/734/w550h184/20200317/9063-iqyryku5234529.jpg)
艰巨的工作获得了回报!从纯化的蛋白样本中,他们确认Orb2能以单体、低聚体以及淀粉样细丝形式存在,并且验证不同形式对蛋白翻译起着抑制或激活的不同作用。
利用冷冻电镜(cryo-EM)技术,研究人员解开了内源性Orb2的结构,分辨率达到2.6埃。高分辨率的蛋白结构让我们看到,内源性Orb2形成了约75纳米长的三重螺旋对称淀粉样蛋白丝,31个氨基酸组成的原纤维核心以亲水性界面相互交叉堆积。而这一点与致病淀粉样蛋白的疏水性核心存在明显差别。
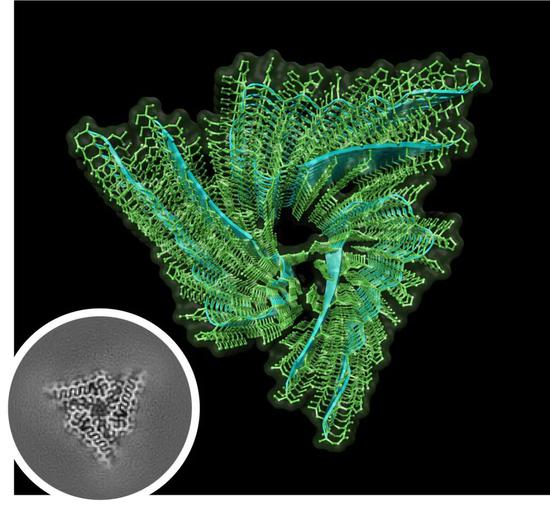 ▲使用冷冻电镜技术结合图像处理技术重建出的Orb2淀粉样蛋白丝核心(图片来源:Si Lab, Stowers Institute for Medical Research)
▲使用冷冻电镜技术结合图像处理技术重建出的Orb2淀粉样蛋白丝核心(图片来源:Si Lab, Stowers Institute for Medical Research)通常淀粉样蛋白与记忆丧失有关,而这种神经元蛋白的淀粉样蛋白帮助记忆形成,研究者猜测,或许就与这种结构特性有关。该研究在结论部分指出,“Orb2的亲水性核心表明,一些神经元淀粉样蛋白可以作为稳定、可调节的记忆底物”。
接下来,研究人员打算确认,在人脑中是否同样有这种具备正常功能的淀粉样蛋白,以及它们对记忆的形成究竟起什么作用。或许我们对淀粉样蛋白“损害神经”的老观念会改变,也会对记忆如何形成有新的认识。
本文文章转载自新浪新闻
 返回顶部
返回顶部 






